- 2026年2月 | 282期
- 2026年1月 | 281期
- 2025年12月 | 280期
- 2025年11月 | 279期
- 2025年10月 | 278期
- 2025年9月 | 277期
- 2025年8月 | 276期
- 2025年7月 | 275期
- 2025年6月 | 274期
- 2025年5月 | 273期
- 2025年4月 | 272期
- 2025年3月 | 271期
- 2025年2月 | 270期
- 2025年1月 | 269期
- 2024年12月 | 268期
- 2024年11月 | 267期
- 2024年10月 | 266期
- 2024年9月 | 265期
- 2024年8月 | 264期
- 2024年7月 | 263期
- 2024年6月 | 262期
- 2024年5月 | 261期
- 2024年4月 | 260期
- 2024年3月 | 259期
- 2024年2月 | 258期
- 2024年1月 | 257期
- 2023年12月 | 256期
- 2023年11月 | 255期
- 2023年10月 | 254期
- 2023年9月 | 253期
- 2023年8月 | 252期
- 2023年7月 | 251期
- 2023年6月 | 250期
- 2023年5月 | 249期
- 2023年4月 | 248期
- 2023年3月 | 247期
- 2023年2月 | 246期
- 2023年1月 | 245期
- 2022年12月 | 244期
- 2022年11月 | 243期
- 2022年10月 | 242期
- 2022年9月 | 241期
- 2022年8月 | 240期
- 2022年7月 | 239期
- 2022年6月 | 238期
- 2022年5月 | 237期
- 2022年4月 | 236期
- 2022年3月 | 235期
- 2022年2月 | 234期
- 2022年1月 | 233期
- 2021年12月 | 232期
- 2021年11月 | 231期
- 2021年10月 | 230期
- 2021年9月 | 229期
- 2021年8月 | 228期
- 2021年7月 | 227期
- 2021年6月 | 226期
- 2021年5月 | 225期
- 2021年4月 | 224期
- 2021年3月 | 223期
- 2021年2月 | 222期
- 2021年1月 | 221期
- 2020年12月 | 220期
- 2020年11月 | 219期
- 2020年10月 | 218期
- 2020年9月 | 217期
- 2020年8月 | 216期
- 2020年7月 | 215期
- 2020年6月 | 214期
- 2020年5月 | 213期
- 2020年4月 | 212期
- 2020年3月 | 211期
- 2020年2月 | 210期
- 2020年1月 | 209期
- 2019年12月 | 208期
- 2019年11月 | 207期
- 2019年10月 | 206期
- 2019年9月 | 205期
- 2019年8月 | 204期
- 2019年7月 | 203期
- 2019年6月 | 202期
衛福部食藥署 2019 年公告《化粧品衛生安全管理法》,特定用途化粧品在 2024 年搶先施行,不同種類的化粧品也將分階段上路實施,2025 年範圍將擴大至嬰兒用與眼唇用等化粧品,14 大類的一般化粧品也將在 2026 年全面納入管制範圍。本文將從法規的沿革談起,分析新法對於產業的衝擊及業者的因應方式,利用實務解說,拆解執行化粧品 GMP 時常見的迷思,讓您不再對新法望之卻步。
目前所稱的新法是在民國 107 年 4 月 10 日三讀通過的《化粧品衛生安全管理法》,其前身是在民國 61 年通過並公布的《化粧品衛生管理條例》。當時正是台灣經濟起飛的年代,各行各業蓬勃發展,化粧品產業也隨著國民所得提高被向上帶動,隨著時代的演變,法規陸續經過六次修訂。最終,在民國 107 年進行第七次的全文修正並更名。
產品推向國際第一步:建置我國化粧品準則
由於國內製造業屬於外銷導向型態,在民國 105 年時任行政院長的林全,為了能讓化粧品產業能夠參與臺美「貿易暨投資架構協定」(Trade and Investment Framework Agreement, TIFA)及「跨太平洋夥伴協定」(Trans-Pacific Partnership, TPP)等國際經濟協定。因而,提出化粧品法規的修訂,讓國內的化粧品衛生安全管理制度與國際接軌。然而,國際政治的關係,目前台灣仍尚未成功參與 TIFA、TPP,但政府即早推動修法才能進一步將化粧品產業推向國際市場。
民國 105 年推動修法時,在法規上除了將名稱改為《化粧品衛生安全管理法》,最重大的轉變就是為了接軌國際法規,修改部分化粧品定義,並增訂化粧品業者、產品資訊檔案(Product Information Files, PIF)及化粧品成分等立法定義。明定化粧品製造場所應符合化粧品優良製造準則(GMP)外,業者必須聘請藥師等人員駐廠監督製造,以確保產品製造流程之安全、 衛生及一致性。
在管理制度上,產品要進行登錄,並建立產品資訊檔案。業者應備有產品直接供應來源及流向之資料,相關資料須留存五年備查。若發現化粧品有嚴重不良反應或危害衛生安全之虞時,應主動回收,並通報主管機關。同時,也針對化粧品廣告進行管理規範,參酌國際間的管理模式,廢除化粧品廣告事前審查制度,最重要的是化粧品不得為醫療效能之標示、宣傳或廣告。
新法兩大重點:人人都是「吹哨者」、以罰鍰代替刑罰
政府也強化了源頭的管理,經過中央主管機關公告之化粧品,需在邊境抽查、抽樣檢驗合格後,才能夠輸入。此次修法最特別的地方在於,增訂「吹哨者條款」,主管機關若發現化粧品業者有違反規定或是產品妨害衛生安全之虞,得採取暫停製造、輸入、回收、沒入銷毀等管制措施。同時也鼓勵民眾檢舉不法,主管機關得酌予獎勵。在懲處規定中亦有重大改變,廢除過往《化粧品衛生管理條例》中的刑罰最重可能入監的規定,修正為行政罰,並增訂罰鍰金額下限及提高罰鍰金額上限。透過罰鍰方式,讓業者進行改正,以符合相關法規。
由此可見,整個法案最主要的核心精神,就是期望業者更加承擔自身的管理責任,並嚴懲故意違法之業者,使整個產業得以提升國際競爭力。
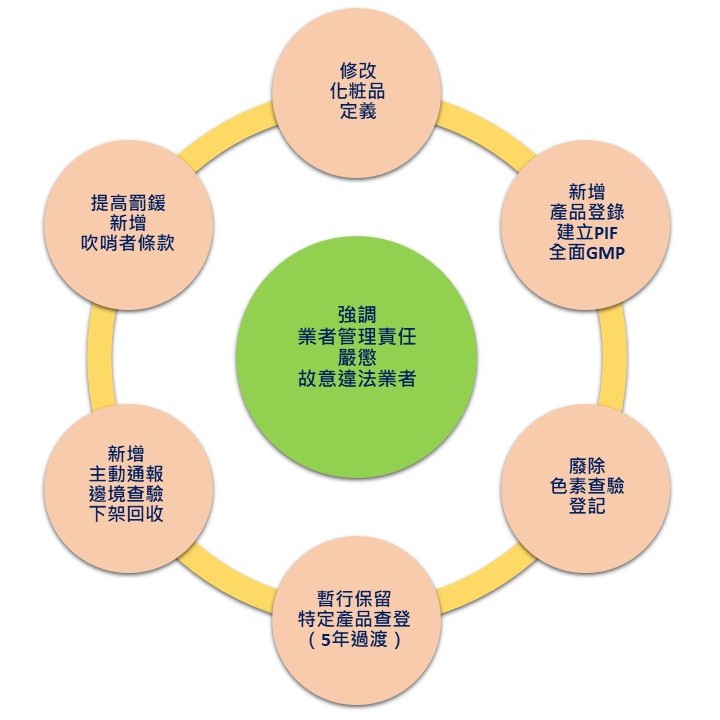
▲ 圖一、《化粧品衛生安全管理法》的核心精神
附帶決議第一條:給予五年過渡期,已輔導代替強制
除了新法,需特別留意的是當時修法通過的附帶決議。首先,在化粧品的分類上進行修正,過往列為一般日用化學品的非藥用牙膏、漱口水,改列入化粧品的管理範圍中,並明列產品登錄、建立產品資訊檔案等規定。在新法上路之初,全台一千多家的化粧品業者中,僅有 57 家通過自願性化粧品製造規範,可清楚看見新法對於產業形成重大衝擊,由於新法在諸多項目大幅提高標準,產業勢必需要時間因應。因此,第一項附帶決議中,要求主管機關衛福部應該要分階段實施,至少給予業者五年的過渡期間,以輔導代替強制,施行建立產品資訊檔案、符合化粧品優良製造規範等規定。
附帶決議二:「情節重大」難以量化,各縣市裁罰標準不一
第二項附帶決議,主要是針對《化粧品衛生安全管理法》第 20 條規定-化粧品之宣傳或廣告違反本法規定情節重大者,應刊播更正廣告。其中「情節重大」屬於較主觀、難認定的不確定法律概念。因此,立法院要求衛福部應該在此法通過後的三個月內與化粧品相關同業公會共同研議「情節重大」的具體意涵。 從現今全台「違反化粧品衛生安全管理法的裁罰標準」中可以看見,因「情節重大」本身難以量化,導致各縣市衛生局的裁罰金額與標準不盡相同。業者在進行管理規劃時,需考量所處縣市,甚至產品銷售所在縣市,以避免遭受懲處。
附帶決議三:安全資料簽署人員目前仍未採認化學、化工相關背景
第三項決議針對新法第四條規定-化粧品製造或輸入業者必須要在化粧品供應、販賣、贈送、公開陳列或提供消費者試用前,建立產品資訊檔案,其中若有安全資料,應由安全資料簽署人員進行簽署。當時要求衛福部在訂定安全資料簽署人員資格時,除了需具藥學、毒理學、醫學、化粧品學等相關領域學位者外,同時須審慎評估化學、化工、生物技術等相關領域學位資格之專業性者。在近期衛福部公告的化粧品產品資訊檔案辦法中可看見安全資料簽署人員資格,仍僅維持原來上述領域學位,並未將化學、化工採納列入其中。
新法變更後分為六個章節,除了第一章的總則與第六章附則外,與大多數業者息息相關的是第二章的製造、輸入及工廠管理的相關要求,其中第四到第九條皆延伸出相關法令,需要特別留意。譬如:產品登入、產品資訊檔案管理、設廠標準等,皆是在此章節中規定。
第三與、第四章是針對廣告及流通管理與化粧品抽查、檢驗及管制。第三章即是先前提及的「不得為醫療效能之標示、宣傳或廣告」。此部分對於代工業者而言,影響層面較小,相關業者需要特別關注的是,「化粧品產品供應來源及流向資料管理辦法」與「化粧品嚴重不良反應及衛生安全危害通報辦法」。第四章「化粧品回收處理辦法」與「化粧品衛生安全案件檢舉獎勵辦法」是業者不可忽視的重點,其中的吹哨者條款,是新法的一大重點。此一章節帶出了本法最關鍵的第五章-「罰則」。企業必須對此章節精熟,才能將觸法情況降至最低。
衛福部在化粧品優良製造準則(GMP)正式實施前發布公告,其中明訂應符合準則之化粧品種類及其實施日期,特定用途化粧品須從民國 113 年 7 月 1 日開始實施,嬰兒用、唇用、眼部用與非藥用牙膏、漱口水這類的一般化粧品則要在民國 114 年 7 月 1 日開始實施。最後則是其他一般化粧品製造場所,要在民國 115 年 7 月 1 日符合準則要求。
另外,廠房面積或其生產設備之電力容量、熱能規模沒有達到工廠認定標準,而免辦工廠登記的手工皂業者,不需要符合化粧品優良製造準則。依照此公告來看,除小型手工皂業者以外,基本上全部的化粧品業者在未來都要符合製造準則。
我國藥品 GMP 的發帶領製藥工業前進國際
相較於食品 GMP 或是藥品 GMP,化粧品優良製造準則,俗稱的化粧品 GMP(Good Manufacturing Practice),算是最晚發展的製造準則。依照時間軸來看,發展最早的是優良製造準是藥品,最主要是為了防止製造過程中交叉污染,或誤用不當原物料造成品質的參差。美國在民國 52 年公佈實施藥品優良製造準則的國家,成為全球最早實施藥品 GMP 的國家。世界衛生組織也在民國 58 年頒布了準則,供世界各國參考。英國緊接其後,在民國 60 年開始施行 GMP。此一準則由歐美開展至亞洲,相鄰且與我國友好的日本,在民國 63 年也制定完成。至於我國藥品 GMP,則是在民國 71 年頒布,推動至今大概也有將進 40 年的歷史。
在台灣藥品優良製造準則的推動,大致可分為三個階段。第一階段是民國 66 年至 77 年,推行藥品 GMP。第二階段是民國 84 年至 94 年推動藥品優良製造確效作業基準,也就是俗稱的 cGMP(Current Good Manufacturing Practice)。民國 96 年則推動符合國際標準的 PIC/SGMP(Pharmaceutical Inspection Co-operation SchemeGMP),此一階段的 GMP 標準,就是目前日常生活常見的藥品優良製造準則。

▲ 圖二、我國西藥製劑工廠實施藥品 GMP 之歷程可分為三大階段
依據資料記載,民國 66 年第一階段藥品 GMP 開始規劃時,衛生署派員赴日瞭解 GMP 的實施情況,希望借鏡已開發國家實例,作為國內推動的參考。當時,我國西藥製劑廠家大約在七、八百家左右。經濟部與當時的衛生署在民國 71 年一月正式成立「GMP 聯合推動小組」,並於同年的五月聯合發布並施行準則。此時,西藥廠數降為 550 家。政府在民國 76 年開始制度化執行 GMP 的藥廠後續查核管理計畫,並由藥檢局在民國 79 年負責規劃、執行,此期間大量淘汰國內不合規的西藥製劑廠,廠家驟減至大約 200 家。
國內在推動第一階段 GMP 期間,國際間已將藥品品質管理從「藥品檢驗」推展到「製程確保」。因此,在民國 84 年我國跟上世界的腳步,公告實施無菌製劑確效作業。同時,為了提升國民用藥品質與拓展我國產品外銷,在民國 88 年公告「藥品優良製造規範」與「藥品確效作業實施表」,分三階段於五年內完成實施。最終在民國 94 年完成全面推動藥品優良製造確效作業基準(cGMP)。此一期間,我國符合 cGMP 的西藥廠從 200 多家降至 163 家。
其後,第三階段衛生署更積極加入國際醫藥品稽查協約組織(The Pharmaceutical Inspection Convention and Co-operation Scheme, PIC/S),該組織成立目的是為了將藥品的法規制度與稽查標準一致化,同時能作為國際合作的平台。為了成為該組織的一員,政府於民國 93 年推動符合國際標準的製造準則,並在三年後正式公告西藥製劑製造工廠實施國際 GMP 標準(PIC/SGMP)。最終,領先日本與韓國在民國 102 年 1 月 1 日以官方身份,正式成為 PIC/S 組織的第 43 個會員。由此可見,我國製藥工業在法規與管理制度及稽查的水準已受國際肯定。民國 103 年已完成全面實施 PIC/SGMP,此時符合標準的西藥廠僅剩約 110 家。
隨著製藥科技的發展,國際間對藥品品質觀念不斷進步更新,藥品也正進入第四階段-藥品優良運銷規範(GDP),確保藥品出藥廠後的儲存、運輸品質,我國製藥工業正積極邁開腳步,朝向國際市場前進。
從藥品優良製造準則的發展歷史可以看見,從發展國內的 GMP 到 cGMP,最終達成 PIC/S GMP,這段過程中,製藥標準的提升與法規限制下,符合廠商數相對減少,導致在業界產生「實施 GMP,工廠關一半」的負面印象。從化粧品產業的角度來看,可借鏡國內導入藥品 GMP 建置的相關經驗,搭配整體背景因素均相對成熟的情況下,不會出現這種廠家數明顯下滑的情況。
政府推行食品 GMP,前路坎坷最終退場
除藥品 GMP 外,我國也曾經推行食品 GMP。經濟部工業局於民國 78 年規劃「食品良好作業規範」認證制度,推行目的是為了提升食品業品質,向消費者傳達出該產品受政府把關與認證,創造讓消費者安心選購的食品市場。此認證制度著重在食品生產品質與衛生安全的優良製造標準,通過認證的產品可在產品上標示「食品 GMP 微笑標章」。認證初期開放 15 個產品類別,直到民國 80 年陸續增加至 25 種產品類別。此時,涵蓋範圍已將大多數食品業者納入其中。

▲ 圖三、工業局推動食品 GMP 目的是打造出食品市場中精品的形象
依據統計,自民國 78 年推行食品 GMP 起,至民國 103 年,將近 25 年的期間,國內已有超過四百家食品業者參與、三千多項食品取得微笑標章的肯定。民國 100 年工業局推行之臺灣製產品 MIT 微笑標章亦採認食品 GMP 微笑標章。以當時有能力取得雙標章,可見業者製造過程有依照相關規範,並確保產品品質與衛生。這背後代表著台灣食品工業實力逐步提升。
當時,我國「食品良好作業規範」認證制度雖然某種程度是政府為產品品質背書,實際執行過程卻相當特別。首先,由 GMP 發展協會負責進行推廣,工業局則是代表政府授證。其中,由經濟部主導,由委外的簽約業者進行相關的追蹤與查核。當時的查核單位為食品工業發展研究所與中華穀類食品工業研究所。有志提升食品品質的業者主動申請食品 GMP,在這過程中除了工廠產線與產品需進行認證,也必須將相關文件送審。另外,製造現場也要接受評核。同時,產品同樣也會進行抽驗與評核,通過後才可以取得食品微笑標章。
食品 GMP 的推動分為三個階段,首先是由官方推動,進入到第二個階段時,由官方與民間業者互相合作,目標是希望最後業者能達成自我管理。但是,第三階段的推動,以當時的臺灣氛圍,難度相對較高。民國 100 年左右,國內接連爆發重大食安事件,如瘦肉精、毒澱粉、塑化劑、回收油等事件,當時較為尷尬的是,許多問題產品皆已取得微笑標章,因而使得大眾對於標章的信用度產生質疑,也因為一連串的食安風暴,加速了食品業進入第三階段的進程。
因社會對微笑標章的不信任度提高,經濟部於民國 103 年針對民眾、學者專家及業者進行民意調查,結果顯示各方皆傾向保留制度,但希望在政府嚴格監督下,轉由民間辦理進行大幅度的改革。因此,食品 GMP 轉型為業者自發性推動,並請第三方公正單位監督,藉此建立產業自主的管理體系。
在社會輿輪的壓力下,「台灣食品 GMP 協會」 在民國 104 年四月更名為「台灣優良食品發展協會(Taiwan Quality Food Association, TQF)」,並於同年六月 GMP 微笑標章由經濟部正式移轉至台灣優良食品發展協會。 同時,於同年 9 月 23 日發布經濟部工化字號第 10400860461 號,說明廢止「食品良好作業規範推行方案」,並自即日起生效。政府推行之食品 GMP 在此時正式退場。

▲ 圖四、TQF 標章取代微笑標章,政府制定之食品 GMP 正式退場
制度缺陷、不肖行為成政府推行食品 GMP 退場關鍵
先前提及我國施行食品 GMP 認證的流程,看似並無太大的問題,然而,政府推行之食品 GMP 為什麼會退場呢?其實與制度的設計有關。在當年的制度中,採行單一條生產線、單一產品的驗證的制度,若同時製造多項產品,必須逐項提交申請給驗證執行單位,進行後續的追蹤與查驗。但因為台灣代工業者比例相對較高,一條產線可能不只產出一樣產品,因此業者在某些品項的食品 GMP 通過後,同一條產線也開始製造其他產品。站在追蹤查驗人員的角度,在查核的過程中,可能因產線並沒有生產取得認證的品項,導致無法及時抽驗到認證產品,形成管理上的死角。對於業者而言,它有申請並取得食品 GMP,但只有部分產品獲得認證。如此便容易在消費者端發生誤解,認為該業者生產的所有產品皆已經過食品 GMP 認可。
另一方面,民國 103 年全臺大約有六千家食品工廠,在當年度僅有大約四百家取得 GMP 認證,取得認證比例不到一成。其原因是因為食品 GMP 在不管是軟體或是硬體,皆有較高標的要求。因此,當年的食安風暴雖有制度不完整的可能因素外,最主要仍是某些供應商的不肖行為導致。
延伸閱讀:
HOT 熱門文章
-
大章小章是什麼?為什麼要分開管理?(上)
【財稅專欄】2022-10-26
-
交通事故的車損應折舊計算(下)
【法律專欄】2025-06-30
-
食品營養標示眉角多,不可不知關鍵技巧!(下)
【專欄文章】2022-09-19
-
食品營養標示眉角多,不可不知關鍵技巧!(上)
【專欄文章】2022-10-11
-
自願減量專案制度及確證/查證要點
【驗證技術通報】2026-03-02